本制品是表达纯化获得的一种由RNA引导的可编辑DNA的重组核酸内切酶,具有基因编辑效率高,脱靶效率低的优点。FnCas12a来源于Francisella novicida U112,分子量大约为154kDa。FnCas12a识别含有TTN的PAM序列,并且FnCas12a的切割位点相对远离其识别位点为多次编辑提供了可能性,这些特点使Cas12a与Cas9可以互为补充。只需简单将guide RNA (gRNA)与Cas12a蛋白相结合,由于该gRNA仅含有crRNA,无需tracrRNA即可实现基因编辑的目的(图1)。
FnCas12a (Cpf1)酶的C端融合了核定位信号(Nuclear localization signal,NLS),NLS有助于FnCas12a进入细胞后定位至细胞核,从而提高基因编辑的效率。

CRISPR-Cas系统作为原核生物的适应性免疫系统,广泛存在于细菌和古细菌中,能够保护其自身不受外源DNA或RNA的影响,是非常常用的基因编辑工具。完整的CRISPR-Cas系统包括介导识别DNA的CRISPR RNAs (crRNAs)和介导切割DNA的Cas核酸内切酶。
FnCas12a包含约1300个氨基酸,含有RuvC-like结构域,同时具有DNA和RNA内切酶的活性。研究表明,FnCas12a与Cas9由于两者结构的不同导致了其分子机制有所差异。CRISPR-Cas12a系统是由Cas12a和gRNA (crRNA,仅需约40~44个碱基)组成。FnCas12a由gRNA引导至互补链,识别互补链上5'端短的富含T碱基(5'-TTN-3')的PAM (Protospacer adjacent motif)序列,然后FnCas12a中的RuvC核酸内切酶结构域逐个切割互补链和靶链,以产生交错的DNA双链断裂,断裂发生在PAM序列3'端的约第18个碱基处,切割产物为5'端突出4或5个碱基的粘性末端(图1)。而CRISPR-Cas9系统是由Cas9和gRNA (crRNA和tracrRNA两个RNA分子融合而成)组成,Cas9在gRNA的引导下,识别3'端富含G碱基(5'-NGG-3')的PAM序列,并且Cas9需要使用HNH和RuvC两个核酸酶结构域协同切割DNA,断裂通常发生在PAM序列5'端的第3个碱基处,最终产生平末端。
基于crRNA效应复合物中的Cas蛋白,CRISPR-Cas系统分为两类。第Ⅰ类CRISPR-Cas系统利用多蛋白效应复合物发挥作用,其可分为3种类型和12种亚型;而第Ⅱ类CRISPR-Cas系统只需用单一的Cas效应蛋白即可对外源核酸序列进行识别和切割,其可分为3种类型和9种亚型。第Ⅱ类CRISPR-Cas系统由于作用机制简单,因此受到广泛关注,其中众所周知的CRISPR-Cas9系统就属于第Ⅱ类2型。本制品与crRNA共同组成了CRISPR-Cas12a系统,该系统则属于第Ⅱ类5型。

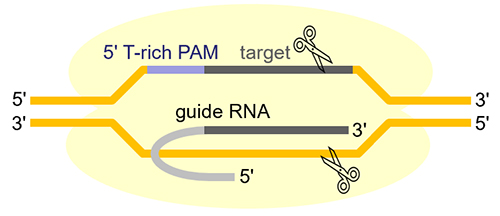
图1.Cas12a核酸酶序列识别与DNA切割示意图。

| 组分 | 100pmol | 500pmol | 2nmol |
| FnCas12a (1μM) | 100μL | 500μL | 2mL |
| 10×Reaction Buffer | 0.5mL | 2mL | 8mL |
保存:-20℃,有效期2年。

500mM NaCl,20mM Sodium acetate,0.1mM EDTA,0.1mM TCEP,50% (v/v) Glycerol,pH6@25℃。

10×Reaction Buffer:
500mM NaCl,100mM Tris-HCl,100mM MgCl2·6H2O,1mg/mL BSA,pH7.9@25℃。

由大肠杆菌表达,表达基因的来源为FnCas12a。

可用于基因编辑和基因检测等。线粒体或质粒DNA等双链环形DNA的线性化。

不含DNA内切酶和外切酶,不含RNA酶。

65℃加热10分钟失活。

- 本制品使用过程中需要确保Nuclease-free,操作时应特别小心,避免被污染。所有操作都需要按照RNase-free的要求进行。
- 对于操作环境中核酸酶的去除,推荐使用核酸酶喷雾清除剂以去除实验桌面上或其它接触面上的核酸酶。反应体系中推荐加入RNase Inhibitor以保护RNA不被降解。

FnCas12a (Cpf1)酶活性检测效果参考图2。
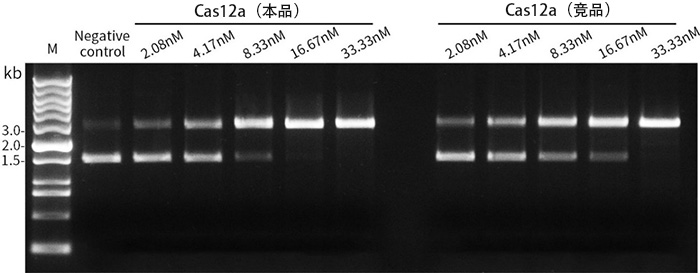
图2.本制品和N公司的Cas12a酶活性检测对比效果图。20μL水、3μL 10×Reaction Buffer、3μL 300nM gRNA (序列为UAAUUUCUACUAAGUGUAGAUCUGUGUGAAAUUGUUAUCCG)、1μL Cas12a (浓度分别为62.5、125、250、500、1000nM,加入体系后的终浓度为2.08、4.17、8.33、16.67、33.33nM),在25℃预孵育10min。然后加入3μL 30nM的pUC18质粒DNA形成30μL反应体系,在37℃孵育10min。加入1μL蛋白酶K,室温孵育10min以终止反应。最后加入6μL 6×DNA上样缓冲液(货号:YT418),进行电泳检测。gRNA与Cas12a结合后,将引导后者至pUC18的第479bp处产生酶切,超螺旋的pUC18质粒被Cas12a酶切后产生线性化的pUC18,迁移率变慢。如图2所示,本制品与N公司的Cas12a具有相近的酶活性。实际效果会因样品、具体实验条件等的不同而存在差异,本图仅供参考。

FnCas12a (Cpf1)体外消化靶DNA
- 溶解并混匀体外消化反应所需的各种溶液。将FnCas12a、gRNA、底物DNA置于冰浴上,使用无核酸酶水稀释gRNA至300nM,底物DNA至30nM。
- 按照下表配制反应体系(以30μL体系为例):
成分 用量 无核酸酶水 20μL 10×Reaction Buffer 3μL gRNA (300μM) 3μL FnCas12a (1μM) 1μL 总反应体积 27μL - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。25℃预孵育10min。
- 加入3μL 30nM底物靶DNA (30μL最终体积),轻轻混匀(用移液器轻轻吹打混匀或用涡旋混合器在最低速度轻轻混匀),随后离心沉淀液体,37℃孵育10min。
- 向每个样品中加入1μL蛋白酶K溶液(20mg/mL),轻轻混匀,室温孵育10min。
- 向反应体系中加入6μL 6×DNA上样缓冲液,然后使用1%琼脂糖凝胶进行电泳分析。
相关搜索:FnCas12a核酸酶,Cpf1,CRISPR,Cas12a,核酸酶,核酸内切酶



